Shibojen GM1-gangliosidoosi
GM1-gangliosidoosi voi kuulostaa tutulta niille shibanomistajille, jotka ovat harkinneet koiransa geenitestausta. Suositun MyDogDNA-geenitestin nettisivu listaa kyseisen sairauden shibojen ainoaksi rotukohtaiseksi tautimutaatioksi, jonka testi paljastaa. Professori Osamu Yamato kuvaili shiban GM1-gangliosidoosin vuonna 2000 ja on sittemmin kartoittanut taudin esiintymistä Japanin ja Tsekkien shiboissa. Syytäkin on, sillä GM1-gangliosidoosi on julma hermorappeumasairaus, joka johtaa varhaiseen kuolemaan ja periytyy salakavalasti peittyen tietyissä shibalinjoissa.
Sairaus nimihirviön takana
”GM1-gangliosidoosi” viittaa siihen, että soluihin kertyy gangliosidi-nimistä rasvamolekyyliä. Kirjaimet GM muodostuvat sanoista gangliosidi ja mono, mikä kuvaa tarkemmin tämän gangliosidityypin kemiallista rakennetta. Gangliosidit ovat tärkeitä rakennuspalikoita etenkin hermosolujen solukalvoilla. Solut elävät jatkuvassa muutostilassa voidakseen vastata ympäristön signaaleihin – niinpä myös vanhoja gangliosideja hajotetaan ja uusia valmistetaan nopeassa tahdissa. Useimmilla gangliosideilla on omat hajottajaentsyyminsä, jotka ovat siis eri geenien koodittamia proteiineja.
GM1-gangliosidin hajotukseen osallistuu entsyymi nimeltä beeta-galaktosidaasi. Mutaatio tämän entsyymin geenissä johtaa virheelliseen rakennusohjeeseen, eikä muodostuva mutanttientsyymi enää toimi. Seuraukset ovat murheellisia sekä solun että sairaan yksilön tasolla. Hajotettavaksi tarkoitettua GM1-gangliosidia kertyy solun ”kierrätyskeskuksiin” eli lysosomeihin. Tämän vuoksi gangliosidoosit luokitellaan myös lysosomaalisiksi kertymäsairauksiksi. Kertyminen on ajan myötä mittavinta hermosoluissa, jotka eivät jakaannu ja siten vähennä yksittäisen solun kertymäainesta. Hermosolujen toiminta häiriintyy, ne turpoavat ja alkavat kuolla. Shibojen GM1-gangliosidoosin huomattavimmat oireet ovatkin neurologisia. GM1-gangliosidoosia esiintyy myös ihmisillä sekä muutamalla muulla koirarodulla. Shiban geenimutaatio ja oirekuva poikkeavat muiden koirarotujen GM1-gangliosidoosista.
GM1-gangliosidoosi vie vuodessa
GM1-gangliosidoosia sairastava pentu vaikuttaa tavanomaiselta pikkushibalta. Omistajan epäilykset heräävät pennun lähestyessä puolen vuoden ikää, kun jokin sen motoriikassa muuttuu. Ensioireita ovat pahenevat tasapainovaikeudet, haparoiva liikkuminen ja pään tärinä. Aivojen surkastumisen edetessä shiba menettää vähitellen näkönsä, liikuntakykynsä, ja lakkaa lopulta reagoimasta ympäristön ärsykkeisiin. Vaikka sairaan koiran älykkyyttä on vaikea arvioida muiden oireiden lomassa, on hermosolujen tuhoutumisen seurauksena luultavasti myös syvenevä kehitysvammaisuus. Sairauden viimeisessä vaiheessa 12-15 kuukauden ikäinen shiba olisi käytännössä lihasten jäykistelystä kärsivä passiivinen vuodepotilas. Näin elämäniloinen shibapentu hiipuu vuoden sisällä oireiden ilmaantumisesta, eikä hoitokeinoa ole. Omistajan tehtäväksi jää seurata taudin vääjäämätöntä etenemistä ja tehdä päätös eutanasian ajankohdasta.
Japanilaisen Sakura-shiban omistaja kirjoittaa aiheesta blogia. Sakura ja sen kaksi pentuesisarusta sairastuivat GM1-gangliosidoosiin. Linkki Sakuran blogiin.
Voiko shibapentuni sairastua?
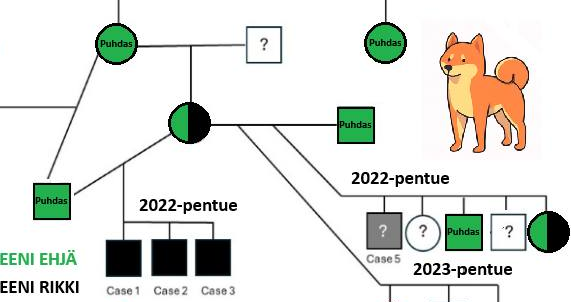
Shibojen GM1-gangliosidoosi on onneksi harvinainen, eikä rotuyhdistyksen tietoon ole toistaiseksi tullut yhtäkään sairasta suomalaista shibaa. Taudin siemenet saattavat silti olla läsnä Suomenkin shibakannassa. Muiden resessiivisesti periytyvien sairauksien tavoin GM1-gangliosidoosi puhkeaa vain silloin, jos pentu on perinyt tautimutaation molemmilta vanhemmiltaan. Pentueen vanhemmat ovat tuolloin – kasvattajan toivon mukaan tietämättä – taudin kantajia. Tällaisessa yhdistelmässä jokaisella pennulla on matemaattisesti 25 % riski olla sairas. Todennäköisyys vastaa valkoisen pennun syntymistä “värikkäille” vanhemmille, jotka kantavat valkoista. (Kyseessä on havainnollistava esimerkki, eikä valkoinen väri sinänsä liity gangliosidoosiin mitenkään.)

Resessiivisen taudin periytymismalli. Esimerkissä sekä isän että emon suvussa esiintyvä ”Reetu” on taudinkantaja, joka on periyttänyt tautialleelin tämän pentueen molemmille vanhemmille. Joka pennulla on nyt 25 % matemaattinen riski periä tautialleeli kummaltakin vanhemmaltaan eli olla sairas. Sattuma vaikuttaa paljon pienissä pentueissa, joten käytännössä sairas voi olla vaikka koko pentue tai ei yksikään.
GM1-gangliosidoosin kantajilla on perimässään geenistä sekä mutanttiversio, genetiikan termein tautialleeli, että normaali alleeli, jonka ohjeilla toimivaa entsyymiä valmistuu riittävästi. Kantajat ovat siis oireettomia. Itse asiassa kantajat saattavat olla jopa näyttelyvoittajia ja suosittuja jalostusuroksia, jotka periyttävät tautialleelia pennuistaan keskimäärin joka toiselle. Näin tautialleeli voi kulkea sukupuussa sukupolvien ajan ja esimerkiksi Suomen pienessä shibakannassa yleistyä sattuman vaikutuksesta. Tällainen sattuma voi olla yksittäisen kantajan suuri pentumäärä. Jos sama kantajashiba esiintyy pentueen sukupuussa sekä emon että isän puolella, muuttuu riski sairaisiin pentuihin teoreettisesta todelliseksi.
Voisiko shibani olla kantaja?
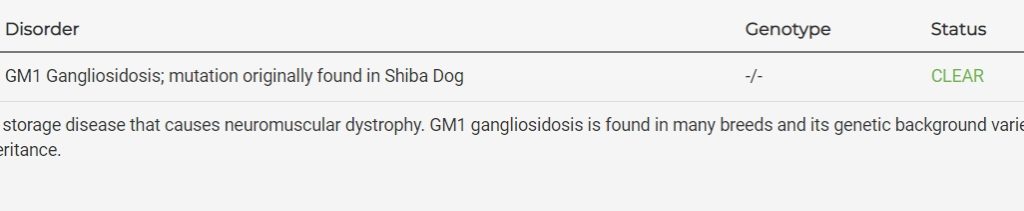
Miten yleinen GM1-gangliosidoosia aiheuttava geenivirhe shiboilla sitten on? Professori Yamaton toteuttamassa tutkimuksessa (julkaisuvuosi 2013) oli testattu yhteensä 590 shibaa Japanin kahdeksalta alueelta. Näistä kuusi paljastui taudin kantajiksi, mikä tarkoitti 1,02 prosenttia testiin sattumanvaraisesti valikoituneista shiboista. Lukema kuulostaa pieneltä, mutta se on syytä suhteuttaa Japanissa vuosittain syntyvän 40 000 shibapennun määrään. Huomionarvoista on se, että puolet löytyneistä kantajista oli kotoisin Kinkin alueelta. Myös monet GM1-gangliosidoosiin sairastuneet shibat vaikuttivat keskittyneen Kinkiin.
Kinkin alueen sairaiden ja kantajien sukutauluja tutkimalla löytyi yhdistäväksi tekijäksi tietyn shibakennelin kaksi kantajaurosta. Vaikka kyseisen kennelin nimi ei ole julkista tietoa, on tässä hyvä käytännön esimerkki resessiivisesti periytyvän sairauden leviämisestä rotukoirissa. Nämä kaksi kantajaurosta todellakin olivat näyttelyvoittajia, joita monet lähialueen kasvattajat käyttivät yhdistelmiinsä.
2019: GM1-gangliosidoosi Japanin ulkopuolella
Tautialleeli on vuoteen 2019 mennessä levinnyt Venäjällä siten, että sairaan pentueen syntyminen tuli mahdolliseksi. Epävirallisen sukupuutietokannan mukaan eräällä kantajauroksella on noin 70 pentua. Matemaattisesti puolet näistä kantaa itsekin tautialleelia ja mahdollisesti periyttää sitä eteenpäin. Kyseessä on ollut onneton sattuma, eikä asia ole ollut tiedossa koiran tai sen omien tuontivanhempien jalostuskäytön aikana. Vastaavia paikallisia populaatioita, joissa tautialleeli on hiljalleen rikastunut, voi olla itämässä muuallakin. Ensimmäinen sairas pentu paljastaa asian, mutta on yleensä vain jäävuoren huippu. Suomessa shibojen uusi PEVISA rajoittaa yksittäisen koiran jälkeläismäärän 25:een.
Professori Yamato on ehdottanut, että ainakin Japanista ulkomaille myytävät shibat testattaisiin tautialleelin suhteen jo Japanissa. Japanin-tuonteja pidetään tyypillisesti arvokkaina jalostuskoirina, ja niiden geneettinen vaikutus muissa maissa voi olla suhteellisen suuri.
2021: GM1-kantajien jalostuskäyttö näyttää ketjuttuneen ainakin neljän sukupolven ajan eri kennelnimien alla. Tautialleelin leviämisen seuranta voi silti olla yhä hallinnassa.
Geenitestaus tuo arvokasta tietoa
Varsin pienen ja vielä nuoren shibapopulaatiomme kannalta voisi olla hyödyllistä testata mahdollisimman moni shiba, jotta saataisiin selville, onko GM1-gangliosidoosia aiheuttava geenimutaatio päässyt jossakin vaiheessa asettumaan tänne tai jopa rikastumaan suomalaisissa shiboissa. Aikaisemmin tautialleelia on kartoitettu länsimaista Tsekeissä vuosina 2005-2006, jolloin tsekkiläisten shibojen rotuyhdistyksen järjestämään näyttelyyn osallistuneista 95 shibasta ei löytynyt taudinkantajia. Toivon mukaan omat shibamme ovat olleet yhtä onnekkaita.
Testattavan shiban ei tarvitse olla itse jalostuskoira tai sellaiseksi suunniteltu. Mahdollisten kantajien jalostuskäyttöä tulisi rajoittaa tai harkita hyvin tarkkaan – geenitestauksen arkipäiväistyessä voi yksittäisiä resessiivisiä tautialleeleja kenties yrittää hallita siten, että kantajan jälkeläisistä valitaan jalostukseen vain tautialleelista vapaita pentuja. Geenitestin näytteeksi ei tarvita välttämättä verikoetta. Usein riittää poskisolunäyte, joka otetaan pyörittämällä pientä näytepuikkoa koiran suussa. GM1-gangliosidoosin testituloksen lisäksi monet kaupalliset DNA-testit kertovat, kantaako punainen shiba valkoista, black & tania tai peräti seesamia väritystä.
Uusi löytö: shibojen GM2-gangliosidoosi
Vuonna 2017 yhdysvaltalaisilta shiboilta tunnistettiin uusi geenivirhe, joka johtaa toisenlaiseen gangliosidoosin muotoon, GM2-gangliosidoosiin. Kyseessä on HEXB-geeni, jonka virhe vaikuttaa kahteen eri entsyymiin, beta-heksosaminidaaseihin A ja B. Taudin oireet, ennuste ja periytymistapa muistuttavat GM1-gangliosidoosia. Kun Missourin yliopiston DNA-pankin 40 shibanäytettä tutkittiin tämän tautialleelin varalta, havaittiin kolme kantajaa. Kyseiset vuonna 2002, 2004 ja 2007 syntyneet shibat eivät tiettävästi olleet sukua toisilleen tai tutkimuksen sairaille shiboille. Erilaisten geenivirheiden mahdollisuus on siis huomioitava, mikäli gangliosidoosiin viittava oirekuva ei selity GM1-tyypin taudin tunnistavalla geenitestillä.
Huom. Eri roduilta on löydetty samasta geenistä erilaisia GM2-tautimutaatioita, ja geenitestit ovat mutaatiokohtaisia eli käytännössä rotukohtaisia. Villakoirien GM2-geenitesti ei tunnista shibojen GM2-mutaatiota ja toisinpäin.
Lähteitä ja luettavaa:
GM1 gangliosidosis in shiba dogs. (Yamato ym., 2000)
Mutation screening of canine GM1 gangliosidosis for preventive measures: absence of the mutant allele in breeding Shiba dogs in the Czech Republic. (Yamato ym., 2009)
GM2 Gangliosidosis in Shiba Inu Dogs with an In‐Frame Deletion in HEXB (Kolicheski ym., 2017)
Canine GM2‐Gangliosidosis Sandhoff Disease Associated with a 3‐Base Pair Deletion in the HEXB Gene (Wang ym., 2018)